2025年6月2日���,球速体育(2696.HK)宣布���,公司创新型抗HER2单抗HLX22的最新研究结果在2025年美国临床肿瘤学会(ASCO)年会上公布���,包括HLX22联合曲妥珠单抗及化疗一线治疗HER2阳性晚期胃癌的II期临床研究(HLX22-GC-201)的疗效与安全性超两年随访更新数据���,以及头对头对比一线标准疗法(曲妥珠单抗+化疗±帕博利珠单抗)的国际多中心III期临床研究(HLX22-GC-301)的研究设计首次发布。HLX22-GC-201研究更新数据显示���,经过长期随访���,HLX22在HER2阳性胃癌治疗中依然展现出稳定的疗效获益���,远超历史数据。HLX22-GC-301研究正在全球范围内高效推进并已在多地完成首例患者给药。目前���,全球尚无同类用于治疗HER2阳性胃癌的HER2双靶向疗法获批准上市。
双靶向双表位结合HER2���,突破胃癌一线治疗桎梏
据GLOBOCAN数据显示���,2022年全球约有100万胃癌新发病例���,逾66万死亡病例���,疾病负担呈现显著地域不平衡[1]���,构成了一大健康问题。多数胃癌患者早期症状隐匿���,确诊时已处于疾病晚期���,总体预后不良���,5年生存率仅为6%[2,3]。尽管近年来靶向治疗(如抗HER2药物)和免疫检查点抑制剂(如抗PD-1/PD-L1单抗)在胃癌的治疗中取得了一定进展[4]���,但鉴于该疾病具有高度分子异质性���,不同亚型患者对化疗���、靶向治疗和免疫治疗的反应差异显著[5]。免疫治疗局限于PD-L1阳性人群���,且疗效改善有限。胃癌尤其是HER2阳性胃癌的整体治疗仍存在巨大的未满足的临床需求。
HLX22是一款靶向HER2的创新型单克隆抗体���,已于2025年获得美国食品药品监督管理局(FDA)和欧盟委员会(EC)授予的孤儿药资格认定(Orphan Drug Designation, ODD)���,用于胃癌的治疗。HLX22可结合在HER2的胞外亚结构域IV���,但结合表位与曲妥珠单抗有所不同���,使得该产品能够与曲妥珠单抗同时结合至HER2���,有效促进HER2二聚体(HER2同源二聚体及HER2/EGFR异源二聚体)的内吞和降解���,将HER2的内吞效率提高了40%-80%���,进而产生更强的HER2受体阻断效果。临床前研究表明���,HLX22与曲妥珠单抗联合治疗能够协同抑制肿瘤细胞增殖和诱导细胞凋亡���,在体内和体外均表现出增强的抗肿瘤活性。
II期研究数据亮点���:超2年随访���,明显延长PFS和OS
HLX22联合汉曲优®(曲妥珠单抗���,美国商品名���:HERCESSI™️���,欧洲商品名���:Zercepac®)治疗HER2阳性胃癌的II期临床研究(HLX22-GC-201)结果显示���,在汉曲优®联用化疗的基础上加入HLX22可提高HER2阳性G/GEJ癌患者一线治疗的生存期和抗肿瘤反应���,且安全性可控���,有望重塑晚期胃癌的一线标准治疗。该研究结果数据首次发布于2024年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)���,其后该研究数据及数据更新亦分别获选发布于Med和2024年欧洲肿瘤学会胃肠道肿瘤研讨会(ESMO GI)���、2025年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)[6-9]���,多次验证了研究结果可靠性的同时���,更进一步提升了该研究在学术界的影响力。
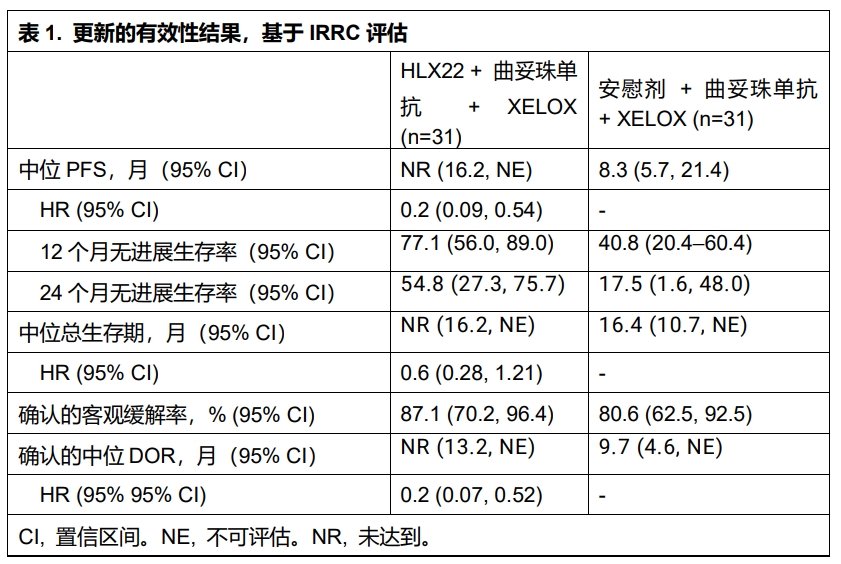
HLX22-GC-201研究纳入未经系统治疗的局部晚期或转移性HER2阳性胃/胃食管结合部癌(G/GEJC)患者���,按1:1随机分配至HLX22+曲妥珠单抗+XELOX组或安慰剂+曲妥珠单抗+XELOX组���,每3周为一个治疗周期。主要终点为独立影像评估委员会(IRRC)根据实体瘤评价标准(RECIST v1.1)评估的无进展生存期(PFS)和客观缓解率(ORR);次要终点包括其他疗效及安全性指标。
截至2024年12月6日���,共有62名患者被随机分组(31 vs 31)���,其中51名(82.3%)为男性。两组中位随访周期分别为28.5个月和28.7个月。主要有效性结果参见表1。两组分别有30例(96.8%)和31例(100%)患者报告了治疗期间不良事件(TEAEs)。17例(54.8%)和15例(48.4%)患者中发生了3级或以上的TEAEs。安慰剂+曲妥珠单抗+XELOX组中���,1例(3.2%)患者发生了HLX22或安慰剂相关的导致死亡的治疗期不良事件(TEAE)。两组各有1例患者(3.2%)报告与HLX22/安慰剂相关的导致治疗终止的TEAE。HLX22-GC-201研究更新结果再次应证了HLX22联合曲妥珠单抗及化疗为HER2阳性G/GEJC患者带来明显的临床获益���,且安全性可控。
III期头对头研究设计���:国际多中心试验全球加速推进
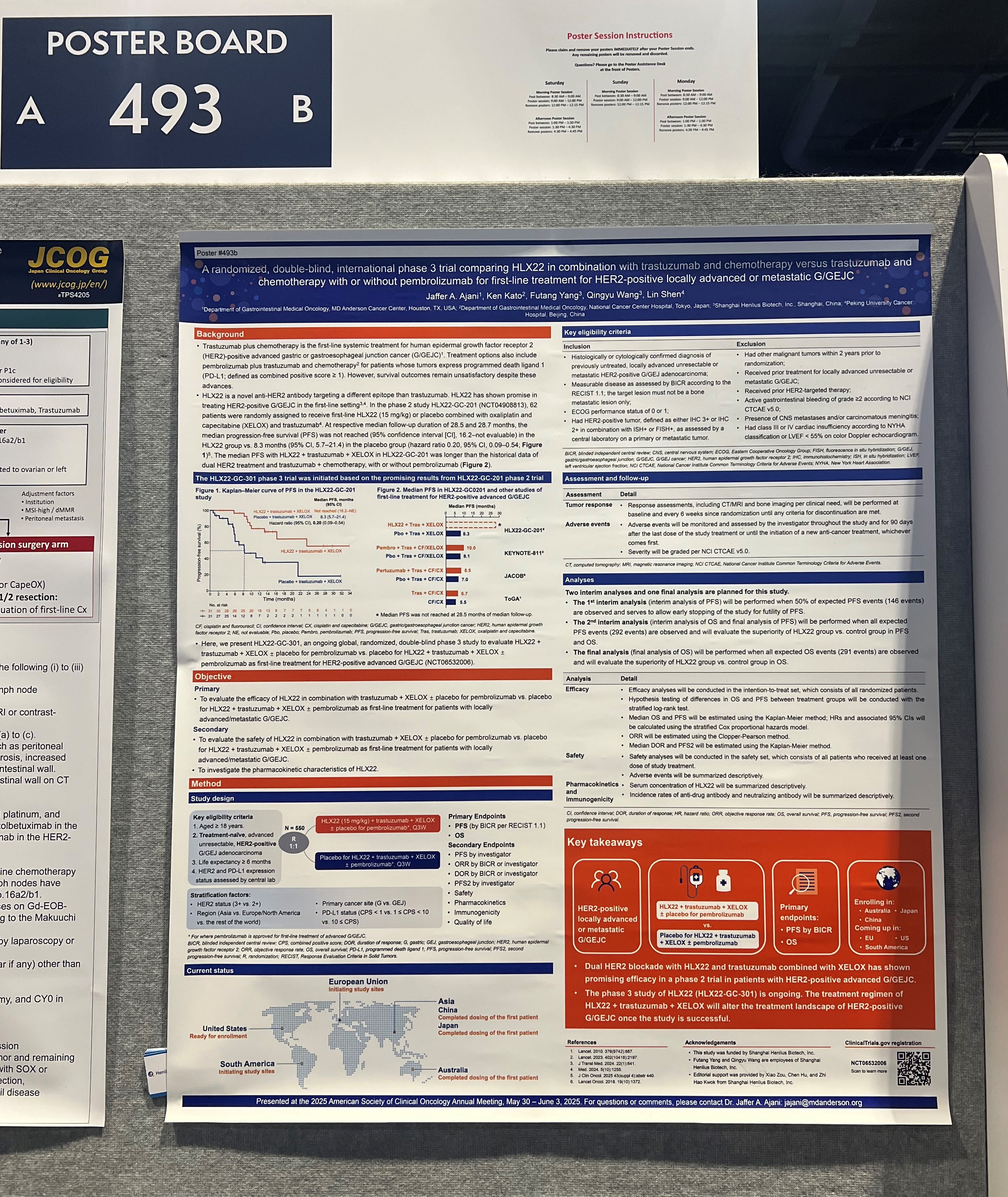
基于前瞻性HLX22-GC-201研究���,公司进一步在更多人群中评价HLX22联合曲妥珠单抗及化疗一线治疗HER2阳性晚期胃癌的疗效与安全性���,并开展一项头对头国际多中心III期临床研究(HLX22-GC-301)。HLX22-GC-301由北京大学肿瘤医院沈琳和MD安德森癌症中心教授���、NCCN胃癌与食管癌专委会主席Jaffer A. Ajani教授共同担任牵头主要研究者。此次ASCO大会首次公布HLX22-GC-301的试验设计���,该研究是一项随机���、双盲���、双臂���、国际多中心III期临床试验���,旨在比较HLX22联合曲妥珠单抗及XELOX方案与曲妥珠单抗及XELOX联合或不联合帕博利珠单抗一线治疗HER2阳性晚期胃/胃食管结合部(G/GEJ)癌的疗效与安全性。
HLX22-GC-301关键入选标准包括经组织学或细胞学确诊���、既往未接受治疗的局部晚期不可切除或转移性���、HER2阳性G/GEJ腺癌;关键排除标准包括既往接受过任何HER2靶向治疗。研究计划从全球多个地区入组约550例患者���,按1:1随机分配接受以下治疗���:HLX22(15 mg/kg)联合曲妥珠单抗及XELOX±帕博利珠单抗安慰剂���,或HLX22安慰剂联合曲妥珠单抗及XELOX±帕博利珠单抗。HLX22的给药在每个21天的治疗周期的第1天通过静脉输注进行���,持续给药至丧失临床获益���、死亡���、出现不可耐受毒性���、撤回知情同意或其他原因终止。分层因素包括HER2免疫组化评分(3+相比2+)���、地理区域(亚洲相比欧洲/北美相比其他地区)���、肿瘤原发部位(胃相比胃食管结合部)及肿瘤PD-L1表达(CPS <1或不可评估相比1≤CPS<10相比CPS≥10)。共同主要终点为独立影像评估委员会基于实体瘤疗效评价标准(RECIST v1.1)评估的无进展生存期(PFS)���,以及总生存期(OS);次要终点包括研究者评估的PFS���、客观缓解率���、后续治疗线的PFS���、缓解持续时间���、安全性���、药代动力学���、免疫原性及生活质量。
值得一提的是���,HLX22-GC-301同步于中国���、澳大利亚���、欧盟���、日本���、美国���、南美洲等国家和地区开设试验中心。截至目前���,该研究已于中国���、日本���、澳大利亚完成首例受试者给药���,并已在美国���、智利���、韩国等国家和地区获得临床试验开展许可。
继HER2阳性胃癌之后���,HLX22的治疗领域已逐步拓宽至乳腺癌疾病领域。2025年4月���,HLX22单抗联合德曲妥珠单抗治疗HER2低表达HR阳性的局部晚期或转移性乳腺癌的II期临床研究(HLX22-BC201)于中国境内完成首例患者给药。HLX22联合德曲妥珠单抗的临床前动物试验显示���,该抗HER2联合疗法展现出协同抗肿瘤作用和良好的安全性���,有望为HER2表达肿瘤患者带来更多获益。未来���,球速体育也将持续探索新型抗HER2靶向疗法在肿瘤中的治疗潜力���,高效推进HLX22的全球临床开发进展���,为全球患者提供更多可负担���、疗效更好的治疗方案。
参考文献
[1] Bray F, Laversanne M, Sung H, et al. CA Cancer J Clin. 2024: 1-35.
[2] Ajani JA. et al. J Natl Compr Canc Netw 2022;20(2):167-92.
[3] Alsina M. et al. Nat Rev Gastroenterol Hepatol 2023;20(3):155-70.
[4] Miao, ZF.,et al. Progress and remaining challenges in comprehensive gastric cancer treatment. Holist Integ Oncol 1, 4 (2022).
[5] Guan, WL.,et al. Gastric cancer treatment: recent progress and future perspectives. J Hematol Oncol 16, 57 (2023).
[6] Jin Li et al., HLX22 plus HLX02 and XELOX for first-line treatment of HER2-positive locally advanced or metastatic gastric/gastroesophageal junction cancer: A randomized, double-blind, multicenter phase 2 study.. JCO 42, 354-354(2024).DOI:10.1200/JCO.2024.42.3_suppl.354
[7] J. Li et al., 422P HLX22 plus HLX02 and XELOX as first-line therapy for HER2-positive advanced gastric/gastroesophageal junction cancer: Updated results from a randomized, double-blind phase II study, Annals of Oncology,Annals of Oncology (2024) 35 (suppl_1): S162-S204. 10.1016/annonc/annonc1482
[8] Li N, et al. A randomized phase 2 study of HLX22 plus trastuzumab biosimilar HLX02 and XELOX as first-line therapy for HER2-positive advanced gastric cancer. Med. 2024;5(10):1255-1265.e2.
[9] Jin Li et al. HLX22 plus trastuzumab and XELOX for first-line treatment of HER2-positive locally advanced or metastatic gastric/gastroesophageal junction cancer (G/GEJC): Updated results with additional patients.. JCO 43, 440-440(2025). DOI:10.1200/JCO.2025.43.4_suppl.440